THUỐC TƯƠNG ĐƯƠNG SINH HỌC LÀ GÌ?
- Thứ ba - 22/08/2023 14:54
- In ra
- Đóng cửa sổ này
THUỐC TƯƠNG ĐƯƠNG SINH HỌC
Sau khi hết thời hạn bảo hộ phát minh, các công ty dược khác được phép sản xuất những thuốc tương tự biệt dược gốc được gọi tên là thuốc generic. Thuốc generic thường được đặt tên thương mại có thể giống hoặc khác với tên chung quốc tế (International Nonproprietary Names - INN).
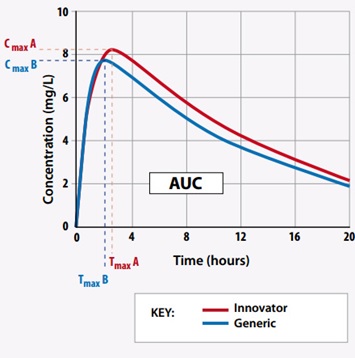
Tương đương sinh học (Bioequivalence): hai thuốc được coi là tương đương sinh học nếu chúng là những thuốc tương đương bào chế hay là thế phẩm bào chế, và sinh khả dụng của chúng sau khi dùng cùng một mức liều trong cùng điều kiện thử nghiệm là tương tự nhau dẫn đến hiệu quả điều trị của chúng về cơ bản được coi là sẽ tương đương nhau.
Thuốc generic được cấp tương đương sinh học là: thuốc generic có nghiên cứu chứng minh tương đương về sinh khả dụng so với thuốc Thuốc phát minh (biệt dược gốc/ thuốc brand name).
1- Phải được thiết kế và thực hiện theo quy định trong Hướng dẫn tiến hành thử tương đương sinh học ASEAN hoặc các hướng dẫn tham chiếu của các tổ chức khác;
2- Đối với các thuốc dạng bào chế giải phóng dược chất biến đổi, dùng đường uống và có tác dụng toàn thân phải thực hiện nghiên cứu khi dùng thuốc ở tình trạng đói và nghiên cứu khi dùng thuốc ở tình trạng no;
3- Đối với các thuốc dạng bào chế giải phóng dược chất ngay, có tác dụng toàn thân, không thuộc các trường hợp quy định tại Điều 5 Thông tư 07/2022/TT-BYT (thuốc generic không thử tương đương sinh học do sẵn có đặc tính tương đương sinh học với thuốc đối chứng) phải thực hiện nghiên cứu khi dùng thuốc ở tình trạng đói. Trường hợp đặc tính dược động học của thuốc đối chứng đã biết là thức ăn ảnh hưởng đến sinh khả dụng hoặc thuốc đối chứng có hướng dẫn sử dụng sau khi ăn, có thể thực hiện nghiên cứu khi dùng thuốc ở tình trạng no thay thế nghiên cứu khi dùng thuốc ở tình trạng đói;
4- Đối với thuốc phối hợp cố định liều, phải nghiên cứu đánh giá tương đương sinh học của tất cả các thành phần dược chất có trong thuốc;
5- Áp dụng thiết kế thử tương đương sinh học cho từng thuốc theo khuyến cáo của cơ quan quản lý dược thực phẩm Mỹ (US FDA) hoặc cơ quan quản lý dược phẩm châu Âu (EMA).

3. Một số thuốc tương đương sinh học tại bệnh viện
Tài liệu tham khảo
1. Thông tư 07/2022/TT-BYT ban hành Quy định thuốc phải thử tương đương sinh học và các yêu cầu đối với hồ sơ báo cáo số liệu nghiên cứu tương đương sinh học trong đăng ký lưu hành thuốc tại Việt Nam bởi Bộ Y tế ngày 05 tháng 9 năm 2022.
2. Thông tư 08/2010/TT-BYT ban hành Hướng dẫn báo cáo số liệu nghiên cứu sinh khả dụng/ tương đương sinh học trong đăng ký thuốc bởi Bộ Y tế ngày 26 tháng 4 năm 2010.
- Các khái niệm
Sau khi hết thời hạn bảo hộ phát minh, các công ty dược khác được phép sản xuất những thuốc tương tự biệt dược gốc được gọi tên là thuốc generic. Thuốc generic thường được đặt tên thương mại có thể giống hoặc khác với tên chung quốc tế (International Nonproprietary Names - INN).
Tương đương sinh học (Bioequivalence): hai thuốc được coi là tương đương sinh học nếu chúng là những thuốc tương đương bào chế hay là thế phẩm bào chế, và sinh khả dụng của chúng sau khi dùng cùng một mức liều trong cùng điều kiện thử nghiệm là tương tự nhau dẫn đến hiệu quả điều trị của chúng về cơ bản được coi là sẽ tương đương nhau.
Thuốc generic được cấp tương đương sinh học là: thuốc generic có nghiên cứu chứng minh tương đương về sinh khả dụng so với thuốc Thuốc phát minh (biệt dược gốc/ thuốc brand name).
- Nghiên cứu tương đương sinh học
1- Phải được thiết kế và thực hiện theo quy định trong Hướng dẫn tiến hành thử tương đương sinh học ASEAN hoặc các hướng dẫn tham chiếu của các tổ chức khác;
2- Đối với các thuốc dạng bào chế giải phóng dược chất biến đổi, dùng đường uống và có tác dụng toàn thân phải thực hiện nghiên cứu khi dùng thuốc ở tình trạng đói và nghiên cứu khi dùng thuốc ở tình trạng no;
3- Đối với các thuốc dạng bào chế giải phóng dược chất ngay, có tác dụng toàn thân, không thuộc các trường hợp quy định tại Điều 5 Thông tư 07/2022/TT-BYT (thuốc generic không thử tương đương sinh học do sẵn có đặc tính tương đương sinh học với thuốc đối chứng) phải thực hiện nghiên cứu khi dùng thuốc ở tình trạng đói. Trường hợp đặc tính dược động học của thuốc đối chứng đã biết là thức ăn ảnh hưởng đến sinh khả dụng hoặc thuốc đối chứng có hướng dẫn sử dụng sau khi ăn, có thể thực hiện nghiên cứu khi dùng thuốc ở tình trạng no thay thế nghiên cứu khi dùng thuốc ở tình trạng đói;
4- Đối với thuốc phối hợp cố định liều, phải nghiên cứu đánh giá tương đương sinh học của tất cả các thành phần dược chất có trong thuốc;
5- Áp dụng thiết kế thử tương đương sinh học cho từng thuốc theo khuyến cáo của cơ quan quản lý dược thực phẩm Mỹ (US FDA) hoặc cơ quan quản lý dược phẩm châu Âu (EMA).


|
Hình ảnh minh họa tương đương về cấu trúc hóa học và sinh khả dụng giữa thuốc Generic và biệt dược gốc
|
3. Một số thuốc tương đương sinh học tại bệnh viện
| STT | Tên thuốc | Hoạt chất | Hàm lượng | Số đăng ký | Cơ sở sản xuất | Nước sản xuất |
| 1 | Insuact 10 | Atorvastatin | 10mg | VD-29107-18 | Công ty cổ phần dược phẩm SaVi | Việt Nam |
| 2 | SaVi Valsartan 160 | Valsartan | 160mg | VD-25269-16 | Công ty CP Dược phẩm SaVi | Việt Nam |
| 3 | IRBESARTAN 150 MG | Irbesartan | 150mg | VD-27382-17 | Công ty cổ phần xuất nhập khẩu y tế Domesco | Việt Nam |
| 4 | Entecavir Stella 0.5mg | Entecavir | 0,5mg | QLĐB-560-16 | Công ty TNHH Liên doanh Stellapharm - Chi nhánh 1 | Việt Nam |
| 5 | Stadnex 20 CAP | Esomeprazol | 20mg | VD-22345-15 | Công ty TNHH Liên doanh Stellapharm - Chi nhánh 1 | Việt Nam |
| 6 | Staclazide 80 | Gliclazid | 80mg | VD-35321-21 | Công ty TNHH Liên doanh Stellapharm - Chi nhánh 1 | Việt Nam |
| 7 | Acyclovir Stella 800mg | Aciclovir | 800mg | VD-23346-15 | Công ty TNHH Liên doanh Stellapharm - Chi nhánh 1 | Việt Nam |
| 8 | LIFECITA 400 | Piracetam | 400mg | VD-30533-18 | Công ty cổ phần dược phẩm Trung ương 1 - Pharbaco | Việt Nam |
| 9 | Vestar MR Tablet | Trimetazidin | 35mg | VN-21408-18 | Healthcare Pharmaceuticals Ltd. | Bangladesh |
| 10 | Drotusc Forte | Drotaverin clohydrat | 80mg | VD-24789-16 | CÔNG TY CỔ PHẦN DƯỢC PHẨM MEDISUN | Việt Nam |
| 11 | Fabadroxil 500 | Cefadroxil | 500mg | VD-29853-18 | Công ty cổ phần dược phẩm Trung ương I - Pharbaco | Việt Nam |
| 12 | Kavasdin 5 | Amlodipin | 5mg | VD-20761-14 | Công ty cổ phần dược phẩm Khánh Hòa | Việt Nam |
| 13 | Auclanityl 875/125mg | Amoxicilin + acid clavulanic | 875mg + 125mg | VD-27058-17 | Công ty Cổ phần Dược phẩm Tipharco | Việt Nam |
| 14 | Dogastrol 40mg | Pantoprazol | 40mg | VD-22618-15 | Công ty CP SX - TM dược phẩm Đông Nam | Việt Nam |
| 15 | Ciprofloxacin | Ciprofloxacin | 500mg | VD-30407-18 | Công ty cổ phần dược phẩm Khánh Hòa | Việt Nam |
| 16 | Cefuroxim 500 | Cefuroxim | 500mg | VD-27836-17 | Công Ty Cổ Phần Dược Phẩm Cửu Long | Việt Nam |
| 17 | PANFOR SR-1000 | Metformin | 1000mg | VN-20187-16 | Inventia Healthcare Limited | India |
| 18 | Triopilin | Diacerein | 50mg | VD-19806-13 | Công ty TNHH BRV Healthcare | Việt Nam |
| 19 | Ceforipin 200 | Cefpodoxim | 200mg | VD-20481-14 | Công ty cổ phần dược phẩm TV.Pharm | Việt Nam |
| 20 | Irbesartan Stella 300 mg | Irbesartan | 300mg | VD-18533-13 | Công ty TNHH Liên doanh Stellapharm - Chi nhánh 1 | Việt Nam |
| 21 | PYMEAZI 250 | Azithromycin | 250mg | VD-24450-16 | Pymepharco | Việt Nam |
| 22 | Rosuvas Hasan 5 | Rosuvastatin | 5mg | VD-25026-16 | Công ty TNHH Hasan - Dermapharm | Việt Nam |
| 23 | Imidu 60 mg | Isosorbid (dinitrat hoặcmononitrat) | 60mg | VD-33887-19 | Công ty TNHH Hasan - Dermapharm | Việt Nam |
| 24 | Nifedipin Hasan 20 Retard | Nifedipin | 20mg | VD-32593-19 | Công ty TNHH Hasan - Dermapharm | Việt Nam |
| 25 | Vixcar | Clopidogrel | 75mg | VD-28772-18 | Công ty TNHH BRV Healthcare | Việt Nam |
| 26 | Carhurol 10 | Rosuvastatin | 10mg | VD-31018-18 | Công ty TNHH BRV Healthcare | Việt Nam |
| 27 | STADNEX 40 CAP | Esomeprazol | 40mg | VD-22670-15 | Công ty TNHH Liên doanh Stellapharm - Chi nhánh 1 | Việt Nam |
Tài liệu tham khảo
1. Thông tư 07/2022/TT-BYT ban hành Quy định thuốc phải thử tương đương sinh học và các yêu cầu đối với hồ sơ báo cáo số liệu nghiên cứu tương đương sinh học trong đăng ký lưu hành thuốc tại Việt Nam bởi Bộ Y tế ngày 05 tháng 9 năm 2022.
2. Thông tư 08/2010/TT-BYT ban hành Hướng dẫn báo cáo số liệu nghiên cứu sinh khả dụng/ tương đương sinh học trong đăng ký thuốc bởi Bộ Y tế ngày 26 tháng 4 năm 2010.